中國科學院上海微系統所與上海交通大學聯合研發出的這種 3D 納米機器人有望在智能仿生感知、藥物遞送等領域發揮巨大的潛力。
3D 打印材料是 3D 打印技術發展的重要物質基礎,在某種程度上,材料的發展決定著 3D 打印能否有更廣泛的應用。人類通過現代技術利用材料(包括天然和合成材料)來尋找新的技術機會,許多新機遇和新發現本質上都植根于制造創新。3D 制造在過去的二十年中得到了深入研究。
隨著材料開發的協同進步,許多應用極大地受益于微 / 納米尺度 3D 結構和設備的高分辨率制造,例如微流體、折射 / 衍射光學、光子和機械超材料。 然而,當特征變得更小,尤其是達到深納米尺度(即<100 nm)時,三維制造技術挑戰變得更加突出, 分辨率、結構穩定性和形狀準確率是關鍵因素。對于細胞支架和治療性微 / 納米機器人等生物醫學應用來說,需要系統地評估 3D 制造結構的生物相容性、物理化學穩定性和功能化的難易程度。
然而,當特征變得更小,尤其是達到深納米尺度(即<100 nm)時,三維制造技術挑戰變得更加突出, 分辨率、結構穩定性和形狀準確率是關鍵因素。對于細胞支架和治療性微 / 納米機器人等生物醫學應用來說,需要系統地評估 3D 制造結構的生物相容性、物理化學穩定性和功能化的難易程度。
近期,中國科學院上海微系統所陶虎團隊與上海交通大學夏小霞、錢志剛合作,用基因重組的蜘蛛絲蛋白 3D 打印出納米機器人,加工精度達到 14 納米。相關研究成果發表在國際知名學術期刊《自然 · 通訊》上。
具體而言,該研究團隊創新開發了基因重組蜘蛛絲蛋白光刻膠,通過優化重組蜘蛛絲基因片段和分子量,結合基于百萬級數量電子的大規模仿真模擬,實時控制加速電壓調控電子在絲蛋白光刻膠里的穿透深度、停留位置和能量吸收峰,實現了分子級別精度的真三維納米功能器件直寫。該技術加工精度可達 14nm,接近天然絲蛋白單分子尺寸(~10 nm),較之前技術提升了 1 個數量級。
這一技術有望用于智能仿生感知、藥物遞送納米機器人等領域。陶虎表示,「14 納米相當于蜘蛛絲蛋白單個分子的尺寸,已經迫近了精度極限。」 論文地址:https://www.nature.com/articles/s41467-021-25470-1
論文地址:https://www.nature.com/articles/s41467-021-25470-1
其中 3D 打印所需的蜘蛛絲蛋白,是研究人員從天然蜘蛛絲中提取出的一段強度好且重復性好的基因序列,進而放入大腸桿菌中進行培養。此外,研究人員使用電子束進行三維光刻來進一步提高加工精度。相對傳統電子束光刻用高電壓(幾十 kV)和薄膠(幾十納米)以保證光刻的準直度和分辨率,該研究從低電壓(幾 kV)和厚膠(幾微米)入手研究。
因為要在血液等環境中游動,納米機器人被設計成了魚的形狀,可以在人體血糖環境中游動,當環境達到設定的酸堿度等條件就能自動降解,釋放出藥物。 通過基因工程重組蜘蛛絲蛋白,可以在納米尺度上創建任意高分辨率、高強度的三維結構。通過在 3D 蛋白質基質不同深度使用高能電子定量定義結構轉變的能力,可以使多態性蜘蛛絲蛋白質接近分子水平。此外,蜘蛛絲蛋白的遺傳或介觀修飾提供了將物理化學、生物功能嵌入和穩定在所制備的三維納米結構中的機會。該研究所用方法能夠快速靈活地制造異質功能化和分層結構的 3D 納米組件和納米設備,為仿生學、治療設備和納米機器人提供了機會。
通過基因工程重組蜘蛛絲蛋白,可以在納米尺度上創建任意高分辨率、高強度的三維結構。通過在 3D 蛋白質基質不同深度使用高能電子定量定義結構轉變的能力,可以使多態性蜘蛛絲蛋白質接近分子水平。此外,蜘蛛絲蛋白的遺傳或介觀修飾提供了將物理化學、生物功能嵌入和穩定在所制備的三維納米結構中的機會。該研究所用方法能夠快速靈活地制造異質功能化和分層結構的 3D 納米組件和納米設備,為仿生學、治療設備和納米機器人提供了機會。
對于這項研究,網友不禁感嘆:科幻逐漸在變成現實。 還有網友表示:「非常棒????,我還盼望著能有類似的機器人能進到血管幫助打通和溶解血栓,這樣很多心臟病人都不用做支架了。」
還有網友表示:「非常棒????,我還盼望著能有類似的機器人能進到血管幫助打通和溶解血栓,這樣很多心臟病人都不用做支架了。」 技術解讀
技術解讀
實驗設置和制造能力
電子束光刻(Electron beam lithography, EBL)以提供深納米尺度的加工分辨率而聞名。當前,EBL 技術的一個主要限制是它們沒有能力進行任意 3D 納米加工。其中,分辨率、結構完整性和功能性等都是最重要的因素。
在深納米尺度上實現 3D EBL 的關鍵是:開發出既可以通過電子束在不同可控深度下進行交聯(cross-link),又具有卓越機械強度且在納米尺寸上保持良好結構完整性的合適材料。
在這項工作中,研究者對商用 EBL 工具——Hitachi S-4800 型掃描電鏡進行了修改,從而可以在曝光期間根據不同的結構幾何來自適應地調整加速電壓(通常為 0.5–10 kV),具體如下圖 1a 所示。
接著,他們通過基因工程將合成重組蛛絲蛋白作為抗蝕劑,將純水作為抗蝕劑顯影劑。具有精確定向的非結晶(水溶)和結晶(不溶于水)蛛絲之間的結構轉變進行明確定義,接近蛋白質基質內的分子水平。定義曝光點的電子的軌跡由施加的加速電壓來調節,從而使得 3 D 納米制造具有很高的結構復雜度。通過這種方法,研究者使用重組蛛絲蛋白制造了一系列具有不同幾何和結構復雜度的 3D 復雜納米結構,其中最小特征尺寸為 14.8nm,具體如下圖 1j 所示。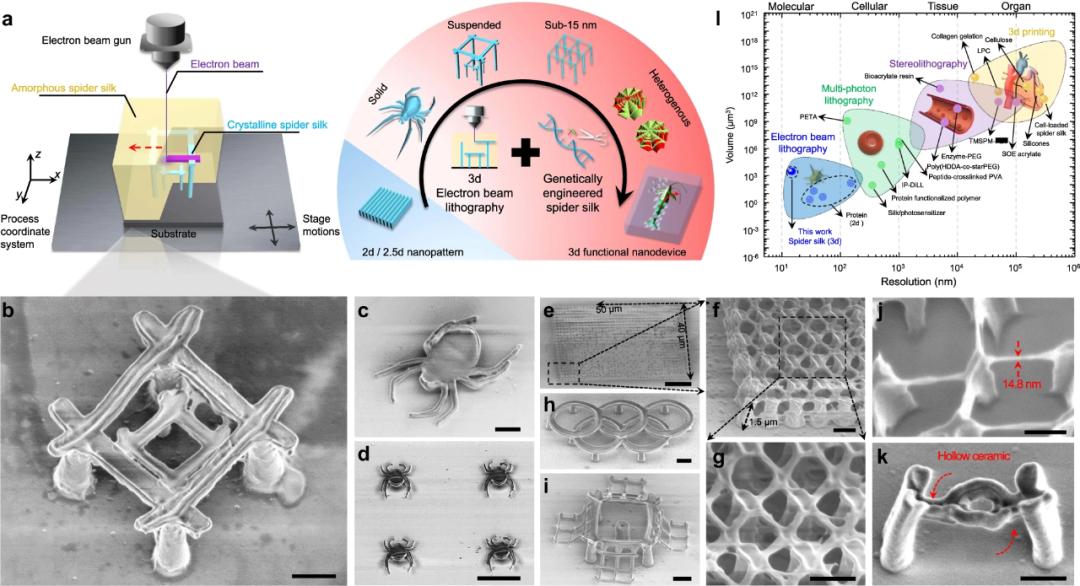 將重組蛛絲蛋白作為抗蝕劑的 3D EBL。
將重組蛛絲蛋白作為抗蝕劑的 3D EBL。
這種方法結合了 MPL(多光子光刻)的無掩模直接 3D 書寫和 EBL 的無可比擬光刻分辨率的優勢。此外,對重組蛛絲蛋白的基因或介觀修改為在制造的納米結構中嵌入和穩定生物化學和 / 或生物功能提供了機會,從而為生物適應和整合提供了巨大的潛力。
制造機理和材料優化
研究者交替觀察了低加速電壓(≤10 kV)電子與厚層抗蝕劑(以μm 計)之間的交互作用,這在以前很少被探究,并且是成功地將 EBL 現有能力從 2D 納米圖案擴展至 3D 納米制造的關鍵。
電子的彈性散射具有相對較大的散射,但能量轉移可以忽略不計。相比之下,電子的非彈性散射具有較小的散射角度,并且可以將一部分能量轉移至抗蝕劑且導致抗蝕劑曝光,如下圖 2a 所示。
眾所周知,非結晶蠶絲和蛛絲蛋白(水溶性)通過與能量電子的交互而產生交聯,然后轉變為結晶相(不溶于水)以實現納米圖案化。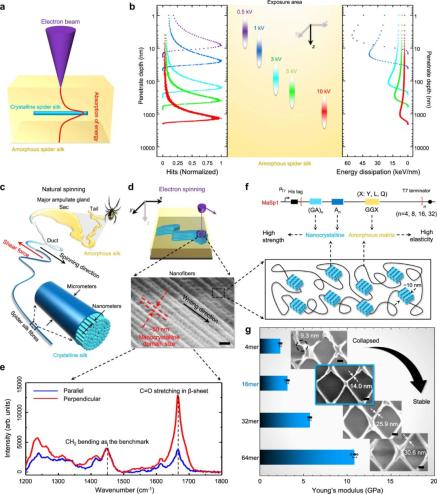 重組蛛絲蛋白中 3D EBL 的機理、材料和制造參數優化。
重組蛛絲蛋白中 3D EBL 的機理、材料和制造參數優化。
在這種情況下,研究者首先使用基于 Casino Monte Carlo 模擬程序修改的自定義代碼來模擬電子的軌跡以及電子和抗蝕劑之間的能量轉移,以探究 3D 空間中電子 - 蛋白質的交互作用,如上圖 2b 所示。
接著,研究者表征了電子輻射后絲蛋白的結晶化以及與書寫方向的關系,結果發現結晶程度高度依賴書寫方向(x–y)。
最后,也是最重要的,與具有類高斯分布的分子量的自然收獲的絲蛋白相比,實驗室制造的重組蛛絲具有定義良好的分子量,并且更適用于納米級的高精度圖案化,從而在分辨率、對比度和長寬比等方面較以往蠶絲蛋白的光刻性能大大增強。
功能性重組蛛絲蛋白的異質、分層和仿生 3D 納米結構
重組蛛絲蛋白的基因或介觀修改可以賦予 3 D 納米組件和納米器件不同的功能。得益于合理的設計和獨創性,蛛絲可以從不同的角度進行重組,并且 3D 納米結構的組成、形狀和功能能夠得到很好地配置。這就為使用 3D EBL 制造的功能性重組蛛絲蛋白中構建異質、分層的納米結構提供了可能。
下圖 3 為使用功能性重組蛛絲蛋白制造的異質、分層和仿生 3D 納米結構: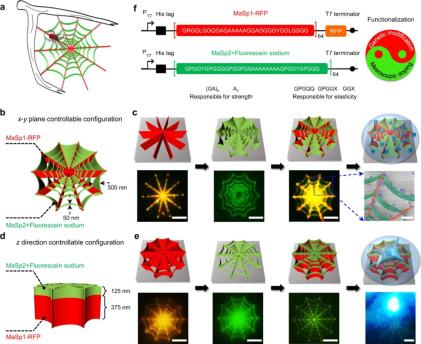 生物燃料驅動、酶輔助的 3D 納米機器人
生物燃料驅動、酶輔助的 3D 納米機器人
創建具有高保真度和易使用的復雜 3D 納米結構的能力,為開發用于治療有效負載靶向制劑的仿生、生物相容、生物活性和生物降解的納米機器人提供了可能。
納米魚的功能性在單個設備中包含三個重要特征。對于裝置推進(device propulsion),葡萄糖氧化酶(GOX)和過氧化氫酶(catalase)這兩種酶嵌入并穩定在 3D 納米魚中,從而使得含葡萄糖環境中的生物燃料驅動的氣體推進達到人體生理水平,如下圖 4a 所示。
對于定向運動控制,研究者在納米魚的特定區域施加了不同劑量的電子輻射,以調整整個裝置的酶活性,從而產生適當的力梯度和不同的運動(如向上、向下、向左、向右以及順逆時針),如下圖 4b 所示。
此外,納米魚中的淺綠色、亮綠色和深紅色熒光分別代表動力學中的低功率、全功率和損耗功率狀態。對于釋放觸發,納米魚可以輕松裝載治療分子以及金納米粒子、熱敏或 pH 敏感酶(如木瓜蛋白酶或胃蛋白酶),從而用于光敏、溫調或 pH 調藥物釋放,如下圖 4c 所示。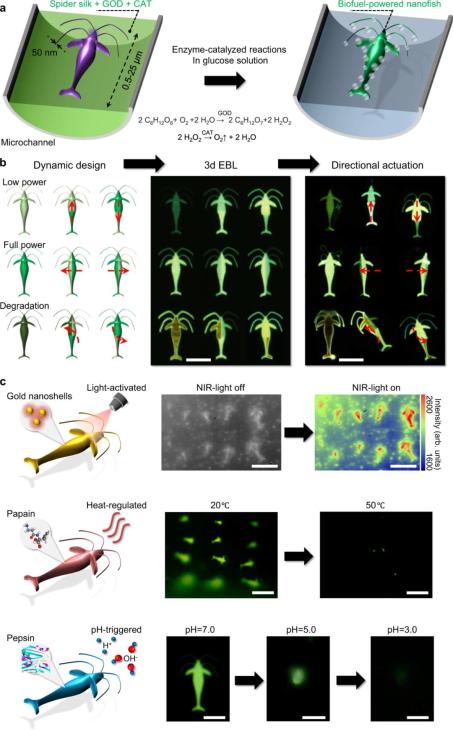 使用 3d EBL 制造的生物燃料驅動的酶輔助蜘蛛絲納米魚
使用 3d EBL 制造的生物燃料驅動的酶輔助蜘蛛絲納米魚
參考鏈接:
http://www.sim.cas.cn/xwzx2016/kyjz/202108/t20210826_6170822.html
http://news.sciencenet.cn/htmlnews/2021/9/465436.shtm
轉載請注明出處。









 相關文章
相關文章
 熱門資訊
熱門資訊
 精彩導讀
精彩導讀
























 關注我們
關注我們




